MIT인공지능연구소 공동연구팀, 사스코로나바이러스-2(SARS-CoV-2) 델타 변이 또는 발생할 수 있는 다른 변이에도 분자 구조와 약물 조합의 시너지를 이해할 수 있는 시너지스틱 약물 조합 발견 AI 딥러닝 모델 '콤보넷(ComboNet)' 개발

전 세계는 여전히 코로나19와 씨름하고 있다. 2020년이 코로나19 (COVID-19)의 해였다면 2021년은 백신의 해가 될 것이며, 2022년은 치료제의 한해가 될 것으로 예상된다.
전염병이 발병한 지 2년이 지나고 백신 접종에도 불구하고, 최근 몇 달 동안 코로나19는 변이를 통한 급속한 확산과 실존적 위협은 효과적인 치료법을 개발해야 한다는 절박한 환경 속에 있다. 또한 전문의들은 환자의 상태가 질병의 진행 과정에서 어떻게 변할지 예측하는 것은 여전히 어렵다.
환자는 앞으로 며칠 안에 개선될 것인가, 아니면 더 많은 중환자실이 필요할 정도로 악화될 것인가, 전례 없는 부담을 겪고 있는 병원들은 환자들이 더 높은 치료를 필요로 하는지를 알고 그에 따라 계획을 세우는 것이 중요하다.

이제, 인공지능(AI)은 백신 개발을 넘어 바이러스 위협에 대처하고 코로나 바이러스 퇴치를 위해 다양한 노력을 기울이고 있다. AI를 이용한 약물 화합물 스크리닝과 약물용도 변경 또는 재배치는 기존 약물이 COVID-19를 포함한 새로운 질병과 도전적인 질병을 치료하는 데 적극 사용되고 있다.
모든 새로운 의학적 질병과 마찬가지로 데이터를 따라잡는 데 시간이 필요한 경우가 많으며 바이러스는 속도를 늦추는 데 시간이 걸리지 않으며 빠르게 돌연변이를 일으켜 기존 약물에 내성을 갖게 되므로 어려운 과제가 된다.
여기에, MIT의 컴퓨터과학 및 인공지능연구소(CSAIL)와 자밀 클리닉(Jameel Clinic for Machine Learning in Health)의 공동 연구팀은 빠르게 확산되는 코로나19의 유발 바이러스인 사스코로나바이러스-2(SARS-CoV-2)에 대한 치료를 위한 약물 조합을 어떻게 식별할 수 있는가에 대한 연구에 집중했다.
연구팀은 연구 결과, 분자 구조와 약물 조합의 시너지를 이해할 수 있는 시너지스틱 약물 조합 발견을 위한 AI 딥러닝 모델 콤보넷(ComboNet)을 개발하고 발표했다.
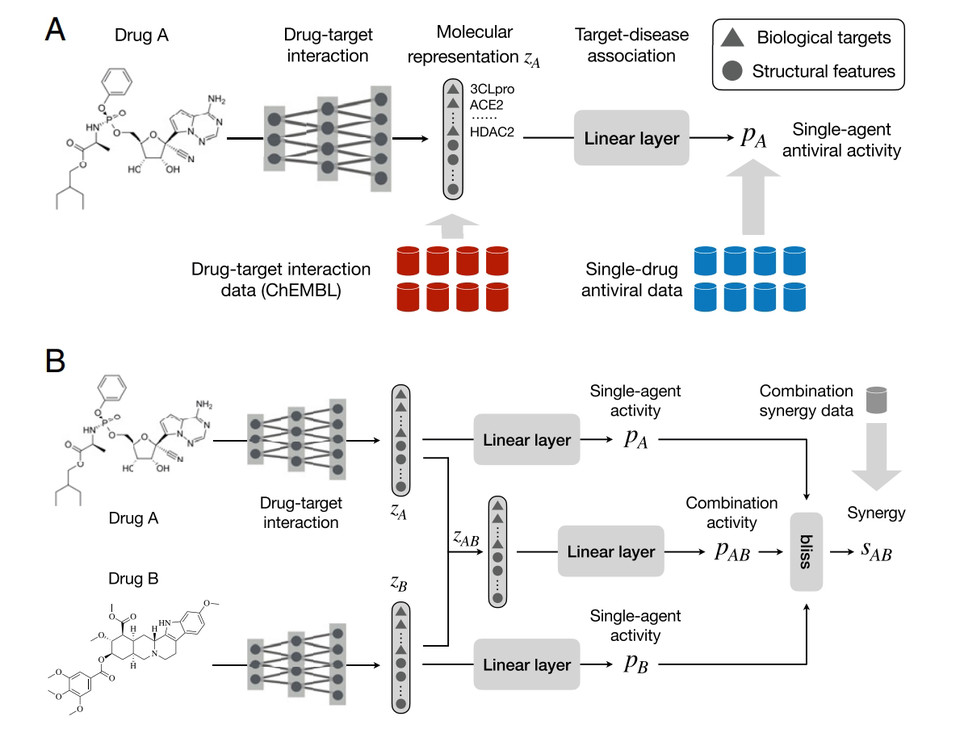
일반적으로 데이터 과학자는 딥러닝을 사용하여 암 및 심혈관 질환과 같은 것에 대한 기존의 대규모 데이터 세트와 함께 약물 조합을 선택하지만 제한된 데이터가 있는 새로운 질병에는 사용할 수 없다.
이처럼 필요한 사실과 데이터가 없었기 때문에 연구팀은 두 개의 능력을 가진 신경망이라는 새로운 접근 방식이 필요했다. 약물 시너지는 종종 생물학적 표적(단백질 또는 핵산)의 억제를 통해 발생하기 때문에 모델은 약물-표적 상호작용 및 약물-약물 시너지를 공동으로 학습하여 새로운 조합을 찾는다.
여기서 약물 표적 예측기(drug target predictor)는 약물과 선택한 질병과 관련된 알려진 생물학적 표적 세트 간의 상호 작용을 모델링한다. 표적-질병 연관 예측기는 약물의 항바이러스 활성을 이해하는 법을 학습한다. 이는 감염된 조직 배양에서 바이러스 수율을 결정하는 것을 의미한다. 함께 두 약물의 시너지를 예측할 수 있다.
이 접근법을 사용하여 현재, FDA에서 코로나19 치료용으로 승인된 렘데시비르(Remdesivir)와 레세르핀(reserpine)뿐만 아니라, 생물학적 분석에서 바이러스에 대해 강력한 것으로 입증된 렘데시비르 및 IQ-1S의 두 가지 새로운 약물 조합을 발견한 것이다.
CSAIL에서 박사 과정을 마친 MIT 및 하버드 브로드 인스티튜트(Broad Institute (Broad Institute of MIT and Harvard)의 웽공 진(Wengong Jin) 박사후 연구원은 "약물과 생물학적 표적 간의 상호 작용을 모델링함으로써 우리는 조합 시너지 데이터에 대한 의존도를 크게 줄일 수 있습니다"라고 말했다.
이어 그는 “약물-표적 상호작용을 고정된 서술자로 사용하는 이전의 접근법과는 달리, 우리의 방법은 분자 구조에서 약물-표적 상호작용을 예측하는 방법을 학습합니다. 이는 많은 양의 화합물이 불완전한 약물-표적 상호작용 정보를 갖고 있기 때문에 유리합니다”라고 설명했다.
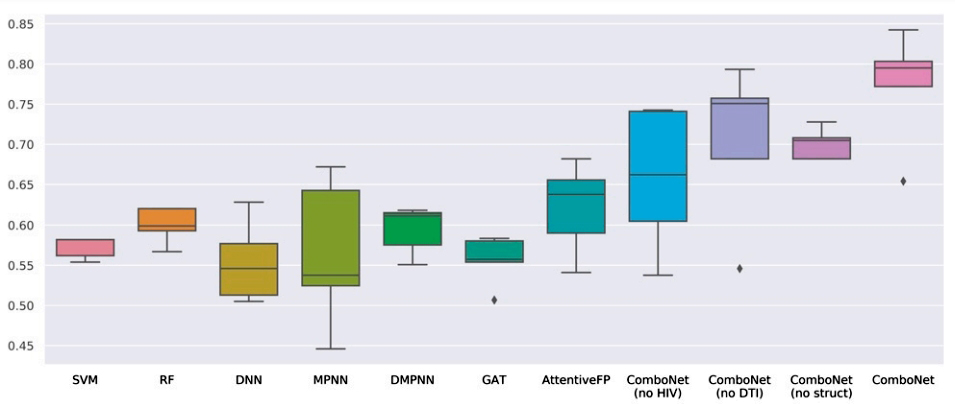
중요한 것은 이 모델이 하나의 SARS-CoV-2 변종에만 국한되지 않는다는 것이다. 또한 잠재적으로 전염성이 증가하는 델타 변이 또는 발생할 수 있는 다른 변이에도 사용될 수 있다. 이러한 균주에 대한 모델의 효능을 확장하려면 관련 돌연변이에 대한 추가 약물 조합 시너지 데이터만 있으면 된다. 또한 연구팀은 HIV 및 췌장암에도 이 접근 방식을 적용했다.
한편, 연구팀은 점진적으로 생물학적 모델링을 더욱 개선하기 위해 단백질-단백질 상호작용 및 유전자 조절 네트워크와 같은 추가 정보를 통합할 계획이다.
그리고 미래 작업을 위한 연구팀의 또 다른 방향은 능동 학습(active learning)을 적용한다는 것이다. 일반적으로 많은 약물 조합 모델은 제한된 크기로 인해 특정 화학 공간에 편향되어 있으므로 예측에 높은 불확실성이 있다. 능동 학습은 데이터 수집 프로세스를 안내하고 더 넓은 화학 공간에서 정확도를 향상시키는 데 큰 도움이 될 것이라고 밝혔다.
이 AI 모델 개발 및 연구 결과는 지난달 29일 美 국립과학원 회보(Proceedings of the National Academy of Sciences)에 '딥러닝, COVID-19 치료를 위한 시너지 약물 조합 식별(Deep learning identifies synergistic drug combinations for treating COVID-19. 다운)'이란 제목으로 발표됐다.

