
인공지능(AI)을 활용하여 자폐 스펙트럼 같은 개인별 증상이 뚜렷한 환자별 뇌질환 유형 분류 및 치료법 개발이 가능해질 전망이다.
특히, 파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국민건강보험공단 진료데이터 따르면, 국내 파킨슨병 환자의 수는 2017년 10만 여명에서 2021년에는 11만6504명으로 5년 사이에 20% 증가한 것으로 나타났으며, 그 수는 매년 꾸준히 증가하고 있다.
영화배우 마이클 제이 폭스(Michael J. Fox), 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 700만명에서 1천만 여명의 환자가 있다고 추정한다.
파킨슨병 같은 만성 퇴행성 뇌 질환의 경우, 생존 환자의 뇌세포에 직접 접근이 제한적이기 때문에 뇌 질환 환자의 세포 데이터를 토대로 환자 질병의 메커니즘 하위 유형을 인공지능으로 예측하는 것은 시도된 바는 없었다.

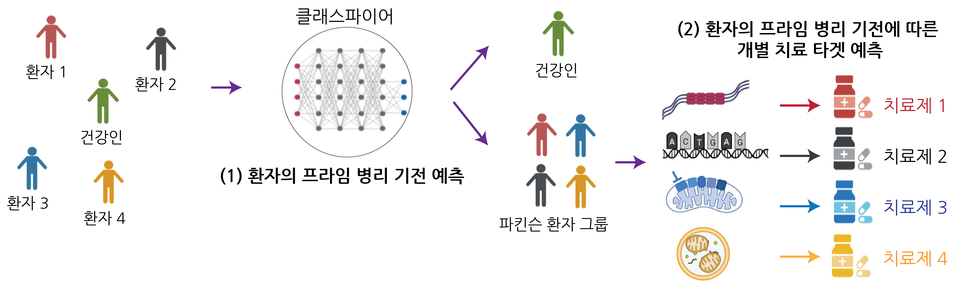
여기에, KAIST(총장 이광형) 뇌인지과학과 최민이 교수 연구팀이 영국 프랜시스 크릭 연구소(Francis Crick Institute)와의 공동 연구로 파킨슨병 환자의 개인별 질병 하위 유형을 예측하는 인공지능 기반의 플랫폼을 개발한 것이다.
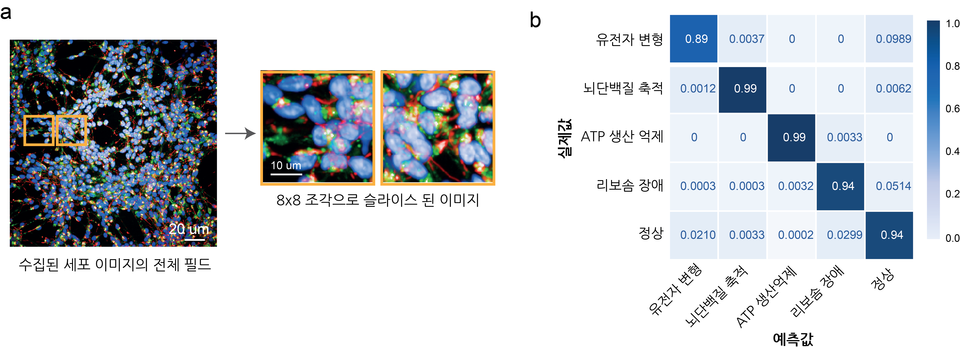
최 교수팀이 개발한 플랫폼은 파킨슨병 환자의 역분화 만능 줄기세포(hiPSC)에서 분화된 신경 세포의 핵, 미토콘드리아, 리보솜 이미지 정보만 학습해 파킨슨 환자의 병리적 하위 유형을 정확하게 예측한다.
이 기술을 활용하면 환자별로 다르게 나타나는 파킨슨병 양상을 겉으로 보이는 발현형이 아닌 생물학적 메커니즘별로 분류할 수 있다. 이를 통해 원인 미상의 파킨슨병 환자가 속한 분자 세포적 하위 유형별로 진단이 가능해져 환자 맞춤형 치료의 길을 열 수 있다. 또 이 플랫폼은 고속의 대량 스크리닝 시스템을 사용하기 때문에 병리적 하위 유형에 적합한 맞춤형 약물 개발 파이프라인으로도 활용될 수 있다.
지금까지 파킨슨병의 치료는 환자 개별의 병리 상태를 고려하지 않고 확률에 기댄 ‘일률적 접근’ 방식을 사용해 왔다. 이러한 접근 방식은 병리적 원인과 치료 방법 사이의 불일치로 인해 치료 효과를 향상하기 어려웠다.
최민이 교수 연구팀이 개발한 플랫폼을 사용하면 개별 환자 뇌세포의 분자 및 세포 정보를 정밀하게 프로파일링할 수 있다. 이를 토대로 환자들의 질병 하위 유형을 정확히 진단할 수 있어서 궁극적으로 ‘정밀 의학 (Precise medicine)’이 가능해진다. 이는 각 개인에게 맞춤화된 치료 (Personalized medicine)로 이어져 치료 효과를 크게 향상할 수 있을 것으로 기대된다.
이 플랫폼은 2012년 노벨의학상 수상 기술인 유도만능줄기세포(iPSC: 성인 피부세포나 혈액에서 얻은 체세포를 태아기의 미분화 상태로 리프로그래밍한 세포. 어떤 장기 세포로도 분화가 가능)를 분화시켜 얻은 뇌세포를 사용하는 ‘접시 속 질병(disease in a dish)’ 패러다임이다.
이는 퇴행성 뇌 질환처럼 병변을 직접 얻을 수 없거나, 인간의 뇌를 정확하게 모사할 수 없는 동물 모델의 한계점을 극복할 수 있는 기술 중 하나로 주목받고 있다. 특히, 접시 속에 배양한 자신의 표적 질병 세포를 순차적으로 이미징하면 일련의 병리적 사건을 추적할 수 있어 질병 진행에 따른 약물 반응 결과를 예측할 수 있다는 이점이 있다.
최민이 교수는 "이번 연구는 실험실에서 얻은 생물학적 데이터를 인공지능에 효과적으로 학습시켜, 정확도가 높은 질병 하위 유형 분류 모델을 생성하는 방법을 구체적으로 소개했다”며, "이 플랫폼은 자폐 스펙트럼과 같이 환자 개인별 증상이 뚜렷하게 다른 뇌 질환의 하위 유형을 분류하는 데에도 유용할 것이며, 이를 통해 효과적인 치료법 개발도 가능해질 것이다”라고 연구의 의의를 설명했다.
한편, 이번 논문은 영국 Medical Research Council(MRC)와 대교-KAIST 인지 향상 연구센터의 지원으로 수행됐으며, 국제 학술지 네이처 머신 인텔리젼스(Nature Machine Intelligence, IF = 25.8)에 '환자 유래 줄기세포 모델을 이용한 파킨슨병의 기전적 아형 예측(Prediction of mechanistic subtypes of Parkinson’s using patient-derived stem cell model-다운)'란 제목으로 지난 10일 게재됐다.
최민이 교수는 퇴행성 뇌질환을 연구하는 신경 생리학자로 영국 국립 뇌신경 전문 병원 부속 연구소와 크릭 연구소의 명예 펠로우다. 최 교수의 퇴행성 뇌질환 연구실은 알츠하이머, 파킨슨병 같은 퇴행성 뇌질환의 단백질 응집, 미토콘드리아 기능 장애 및 신경염증의 메커니즘을 이해하여 궁극적으로 퇴행성 뇌질환자를 위한 맞춤형 치료 플랫폼 개발을 목표로 하고 있다.
이를 위해 환자 유도 맞춤형 줄기세포 (hiPSC), 미토콘드리아 기능 장애/단백질 응집 모델, 인공지능 머신러닝을 이용한 질병 예측 기술 등을 광범위하게 활용하고 있으며, 2023년 2월 KAIST 교수로 임용되어 뇌질환 치료 연구실에서 연구를 이어가고 있다.

